PALLAS: contra-indicatie dronedarone bij chronisch AF
Op maandag 14 november jl., tijdens de Late Breaking Clinical Trials van de American Heart Association 2011, werden de lang verwachte resultaten van de voortijdig beëindigde PALLAS-studie gepresenteerd. In PALLAS werden hoog-risicopatiënten met chronisch boezemfibrilleren of –flutter gerandomiseerd naar dronedarone 400 mg 2dd of placebo.
Wat ging er aan PALLAS vooraf?
In een reeks van klinische trials werd onder andere al eerder aangetoond dat dronedarone frequentie verlagend werkt (ERATO-trial), dat met dronedarone ten opzichte van amiodarone minder goed sinusritme wordt behouden, maar dat dronedarone veel beter wordt verdragen (DIONYSOS-trial). Dronedarone verhoogde bij patiënten met hartfalen cardiovasculaire mortaliteit (ANDROMEDA-trial).
Ten slotte werd in de grootste studie ooit uitgevoerd met een antiaritmicum droneadrone getest bij ruim 4000 patiënten met paroxysmaal of persisterend boezemfibrilleren of –flutter (ATHENA-studie). Na een gemiddelde follow-up van 21 maanden gaf gebruik van dronedarone voor het gecombineerde eindpunt cardiovasculaire hospitalisatie en mortaliteit een relatieve risicoreductie van 24% (absolute afname van 39.4 naar 31.9%), 29% relatieve risicoreductie van cardiovasculaire mortaliteit en een 34% relatieve risicoreductie van het optreden van strokes.
In ATHENA converteerde 12.8% van de placebogroep naar permanent boezemfibrilleren, en 7.6% van de dronedaronegroep. Ook in deze kleinere groep werden dezelfde positieve resultaten van dronedarone gezien. Dit laatste leidde tot het opzetten van de PALLAS-studie. De studie werd gepowered op een inclusie van 10800 patiënten en het optreden van 844 primaire events.
De PALLAS-studie
In PALLAS werden patiënten geïncludeerd met langer dan 6 maanden bestaand permanent boezemfibrilleren of –flutter, een leeftijd ≥ 65 jr. én een opname voor hartfalen in het afgelopen jaar of een verminderde kamerfunctie met een ejectiefractie van < 40%, en/of een voorgeschiedenis met coronair-, cerebraal- of perifeer vaatlijden en/of een leeftijd > 75 jaar en hypertensie en diabetes. Patiënten werden gerandomiseerd naar dronedarone 400 mg 2dd of placebo.
In juni werd PALLAS om veiligheidsredenen voortijdig gestaakt, nadat 3236 patiënten waren geïncludeerd. Bij een gemiddelde follow-up van 3.5 maand was er grofweg een verdubbeling in mortaliteit, hartfalen en strokes en een verdrievoudiging van aritmische mortaliteit. Deze negatieve effecten werden gezien in alle subgroepen, met name ook ongeacht kamerfunctie, NYHA klasse en digoxinegebruik.
PALLAS: relatieve reductie dronedarone vs placebogemiddelde follow-up 3.5 maand
| End point | HR (95% CI) | p |
| Stroke, MI, systemic embolism, or CV death | 2.29 (1.34-3.94) | 0.002 |
| Death or unplanned CV hospitalization | 1.95 (1.45-2.62) | <0.001 |
| Mortality | 1.94 (0.99-3.79) | 0.049 |
| CV death | 2.11 (1.00-4.49) | 0.046 |
| Arrhythmic death | 3.26 (1.06-10.00) | 0.03 |
| Stroke | 2.32 (1.11-4.88) | 0.02 |
| HF hospitalization | 1.81 (1.10-2.99) | 0.02 |
| HF event or hospitalization | 2.16 (1.57-2.98) | <0.001 |
Samenvattend geeft dronedarone in patiënten met chronisch boezemfibrilleren een toename van mortaliteit, hartfalen en stroke, en is dus voor deze patiëntengroep gecontra-indiceerd. De resultaten van de PALLAS zijn na te lezen in de online publicatie in het New England Journal of Medicine.
Marco Alings,
Amphia ziekenhuis, Breda
Stroke, systemic embolism, myocardial infarct or cardiovascular death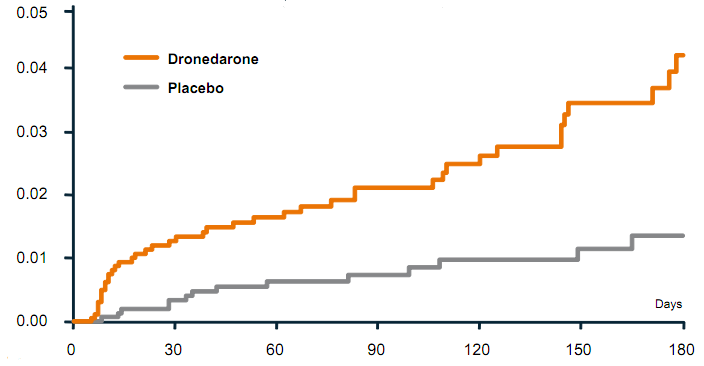
Presentatie PALLAS AHA 2011
Discussant PALLAS AHA 2011
Summary PALLAS AHA 2011
Publicatie NEJM PALLAS
